CoronaVac, Sputnik, Novavax… Nos últimos meses, esses termos relacionados à busca por uma vacina contra a covid-19 passaram a fazer parte de nosso vocabulário. Afinal, é consenso entre os especialistas que um imunizante seguro e eficaz será a única forma de acabar de vez com a pandemia, com a diminuição definitiva dos números de casos, hospitalizações e mortes.
Não é exagero dizer, portanto, que acompanhamos em tempo real uma corrida contra o relógio: laboratórios farmacêuticos, universidades, centros de pesquisa e governos do mundo todo trabalham dia e noite para desenvolver uma solução capaz de nos resguardar contra o Sars-CoV-2, o coronavírus responsável pela crise sanitária global.
Em seu último relatório, publicado no dia 19 de outubro, a Organização Mundial da Saúde (OMS) calcula que 44 candidatas à vacina estão nas fases 1, 2 ou 3 de estudos clínicos, que envolvem testes com seres humanos. Há ainda mais de uma centena de outras formulações na etapa pré-clínica de pesquisas, com células e cobaias.
Mas como elas funcionam? Como agem em nosso organismo? E o que falta para finalmente chegarem à população? De maneira geral, podemos dividir os imunizantes contra a covid-19 que estão mais adiantados em quatro grandes grupos, como você confere a
Vacinas com vírus inativado
Desenvolvidos há cerca de 70 anos, esses imunizantes são feitos a partir do próprio vírus (ou da bactéria, se for o caso). Ele suscita uma resposta de nosso sistema de defesa, que fica preparado para reagir adequadamente diante de uma infecção de verdade.
Fim do Talvez também te interesseMas se o próprio causador da enfermidade está presente na formulação, como é que ele não provoca a doença?
"São utilizadas técnicas de laboratório que inativam o agente infeccioso, de modo que sua replicação se torne inviável. Mesmo assim, isso produz a reação imunológica desejada", explica a microbiologista Natalia Pasternak, presidente do Instituto Questão de Ciência.
Muitas das vacinas que tomamos de rotina, como aquelas que protegem contra a hepatite A, a gripe e a poliomielite (na versão injetável), fazem parte dessa turma. O principal ponto positivo aqui é a experiência de décadas e mais décadas de seu uso na saúde pública.
A desvantagem delas está no custo e no tempo mais demorado de produção.
"É necessário cultivar grandes quantidades de vírus e fazer esse processo de inativação. Além disso, essa técnica não rende muito em doses por litro", avalia Natalia.
Para a covid-19, há duas candidatas na fase mais avançada dos testes clínicos que apostam nessa estratégia de inativar os vírus. Pelo que se sabe até o momento, são necessárias duas doses para surtir efeito.
A mais conhecida no Brasil é a CoronaVac, desenvolvida em conjunto por sete instituições, com destaque para a parceria entre a empresa chinesa Sinovac Biotech e o Instituto Butantan, em São Paulo.
A outra concorrente que usa vírus inativado também vem da China. Ela ainda não tem nome definido e está sendo elaborada pelo Instituto de Produtos Biológicos de Wuhan, a farmacêutica Sinopharm, o Grupo Nacional de Biotecnologia da China, a empresa G42 Healthcare e pelos Serviços de Saúde de Abu Dhabi. Os testes de fase 3 já contam com mais de 60 mil voluntários em três países: Peru, Marrocos e Emirados Árabes Unidos.
Vacinas com vírus inativado são feitos a partir do próprio patógeno
Vacinas de subunidade proteica
Por que usar o vírus inteiro se você pode selecionar apenas um pedacinho dele ou construir uma partícula sintética, parecida com a original? Esse é o raciocínio por trás do desenvolvimento dos imunizantes de subunidade proteica.
"A vacina que resguarda contra a hepatite B é um exemplo dessa tecnologia", lembra a imunologista Cristina Bonorino, professora titular da Universidade Federal de Ciências da Saúde de Porto Alegre e membro do Comitê Científico da Sociedade Brasileira de Imunologia.
Uma característica das vacinas deste grupo é que elas geralmente precisam vir acompanhadas de uma substância adjuvante, outra proteína que dá um reforço e estimula uma resposta mais contundente do sistema imunológico.
Para a covid-19, uma candidata que desponta na dianteira das pesquisas é a NVX-CoV2373, feita pelos laboratórios Novavax e Takeda. Nas fases 1 e 2, ela foi testada na Austrália e na África do Sul. Agora, passa pela etapa final de estudos com mais de 18 mil voluntários no Reino Unido. Em um recente comunicado para a imprensa, os laboratórios estimaram que, se tudo der certo e o produto mostrar eficácia, poderão ser produzidas cerca de 1 bilhão de doses ao longo de 2021.
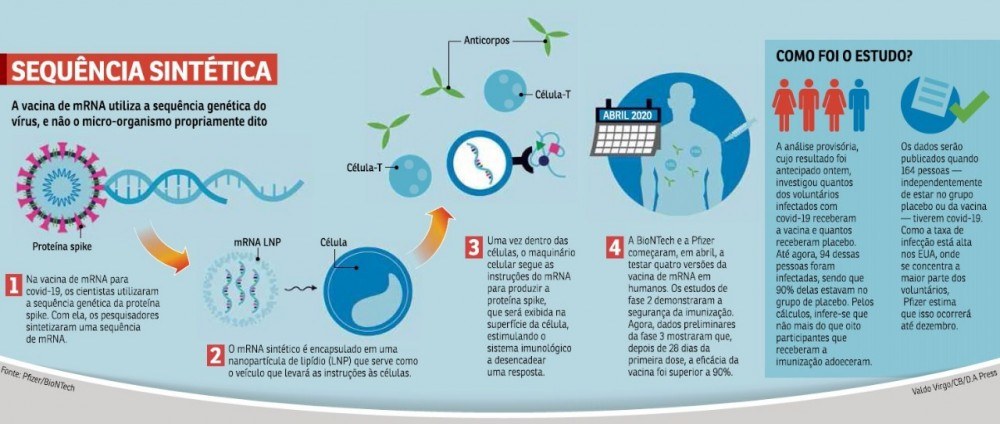
Vacinas baseadas em RNA
Mais modernas, elas são construídas a partir de informações genéticas para conferir uma proteção contra determinada doença. Funciona assim: no laboratório, os cientistas selecionam alguns genes do vírus e fazem modificações nele.
Esse material é injetado no organismo e passa instruções para que as próprias células fabriquem proteínas virais. O sistema de defesa, por sua vez, reconhece aquela informação como uma ameaça e gera uma resposta imune.
Até o momento, não existe nenhuma vacina registrada e utilizada em larga escala deste tipo.
São dois os exemplos de candidatas à vacina contra a covid-19 mais adiantadas desta turma: a mRNA-1273 (da ModernaTX com outras duas instituições) e a BNT162 (da Pfizer com outras duas instituições).
Apesar de terem uma produção simples e rápida, as vacinas baseadas em RNA podem representar um desafio do ponto de vista logístico, pois elas tendem a ser muito sensíveis e se degradam quando expostas a luz, calor ou enzimas do ambiente.
Em tese, serão necessários locais com uma higiene e temperatura com controle rigoroso para a aplicação das doses. Isso, claro, pode inviabilizar sua distribuição para regiões mais remotas do globo.
Vacinas com vetor viral não replicante
Cristina Bonorino define esse grupo como "moléculas Frankenstein". "A gente utiliza a casquinha de um outro vírus, que não causa doença e nem se replica, e colocamos dentro informações do material genético do coronavírus", conta a médica.
Há ao menos quatro pretendentes em fase 3: o Ad5-nCoV (CanSino Biologics e outras dez instituições), o Ad26.COV2.S (Johnson & Johnson e outras duas instituições), o AZD1222 (Universidade de Oxford, AstraZeneca e outras sete instituições) e o Gam-COVID-Vac (também conhecida como Sputnik V, do Instituto de Pesquisa Gamaleya em Epidemiologia e Microbiologia e outras seis instituições).
Nas últimas semanas, a vacina Sputnik V ganhou os holofotes com a sua aprovação na Rússia. O fato levantou uma série de críticas, pois os resultados de segurança e eficácia não foram publicados e, portanto, não eram conhecidos pela comunidade científica internacional.
Outra representante bastante conhecida é a candidata da Universidade de Oxford, na Inglaterra, e da farmacêutica AstraZeneca. Os testes de fase 3 incluem voluntários brasileiros e há um acordo com o Ministério da Saúde e a Fundação Oswaldo Cruz (FioCruz) para uma eventual produção de doses em território nacional.
O que falta para elas ficarem prontas?
Uma lembrança: a aprovação de uma vacina não significa que ela estará disponível prontamente
Todas as candidatas à vacina citadas ao longo da reportagem estão iniciando ou em meio à fase 3 dos testes clínicos. Nesse momento, o objetivo é aplicar o imunizante em milhares de voluntários e acompanhá-los por determinado período de tempo.
Detalhe importante: uma parte desses indivíduos recebe a vacina de verdade, enquanto outra parcela toma doses placebo, que não tem efeito algum sobre o sistema imunológico.
A partir dessa experiência, os cientistas vão poder conferir se as pessoas vacinadas desenvolveram ou não reações adversas e se ficaram mais protegidas (ou não) da infecção pelo coronavírus quando comparadas ao grupo do placebo.
Para determinar o momento em que os testes podem ser finalizados, os autores definem uma quantidade mínima de eventos. "Nesse contexto, um evento é quando uma pessoa que faz parte do estudo fica doente e tem diagnóstico confirmado de covid-19", diz Natalia.
Vamos pegar o exemplo da CoronaVac, elaborada pela Sinovac e pelo Instituto Butantan: de acordo com as informações publicadas no ClinicalTrials.Gov, site do governo americano que registra os estudos clínicos, os testes serão concluídos quando for atingida a marca de 150 eventos. A data para finalizar todo o estudo está agendada para outubro de 2021.
Mas como então governantes e gestores públicos dizem que a vacina começará a ser produzida e distribuída já em dezembro de 2020? "Os fabricantes farão análises interinas, com um número menor de eventos registrados. Se os resultados parciais forem robustos, eles já pedirão uma aprovação emergencial para as agências regulatórias", antecipa Natalia.
Cristina Bonorino vê essa antecipação ensaiada por governos e empresas com ressalvas. "Precisamos respeitar o protocolo. É temerário você liberar qualquer vacina sem os resultados completos. Por mais que as agências regulatórias e os cientistas sofram pressão, devemos esperar para ter certeza de que aquele produto vai funcionar de verdade", afirma.
Outra discussão importante está nos grupos que poderão receber as vacinas. Por ora, muitas das candidatas só são testadas em adultos de 18 a 59 anos. Isso significa que não sabemos ainda se elas serão seguras e efetivas em idosos, por exemplo, que são um dos grupos de risco para a covid-19.
Por fim, é preciso levar em conta que a aprovação de uma vacina, qualquer que seja, não significa que ela estará disponível prontamente. "A liberação significa o início da fabricação em massa, da organização de campanhas, do treinamento das equipes de saúde, da organização das cadeias de transportes… E isso tudo leva tempo", acrescenta Natalia.
Na corrida para acabar com a pandemia, as próximas análises preliminares dos estudos de fase 3 são aguardados com ansiedade para os próximos meses. Em meio a tantas expectativas, projetos e promessas, é preciso tomar cuidado para que nenhum concorrente queime a largada.
- André Biernath
- Da BBC News Brasil em São Paulo